はじめに
細胞治療・遺伝子治療といった新たな治療法が、世界各国で注視されている。
今回は中国における現状を、政策面から紹介したい。
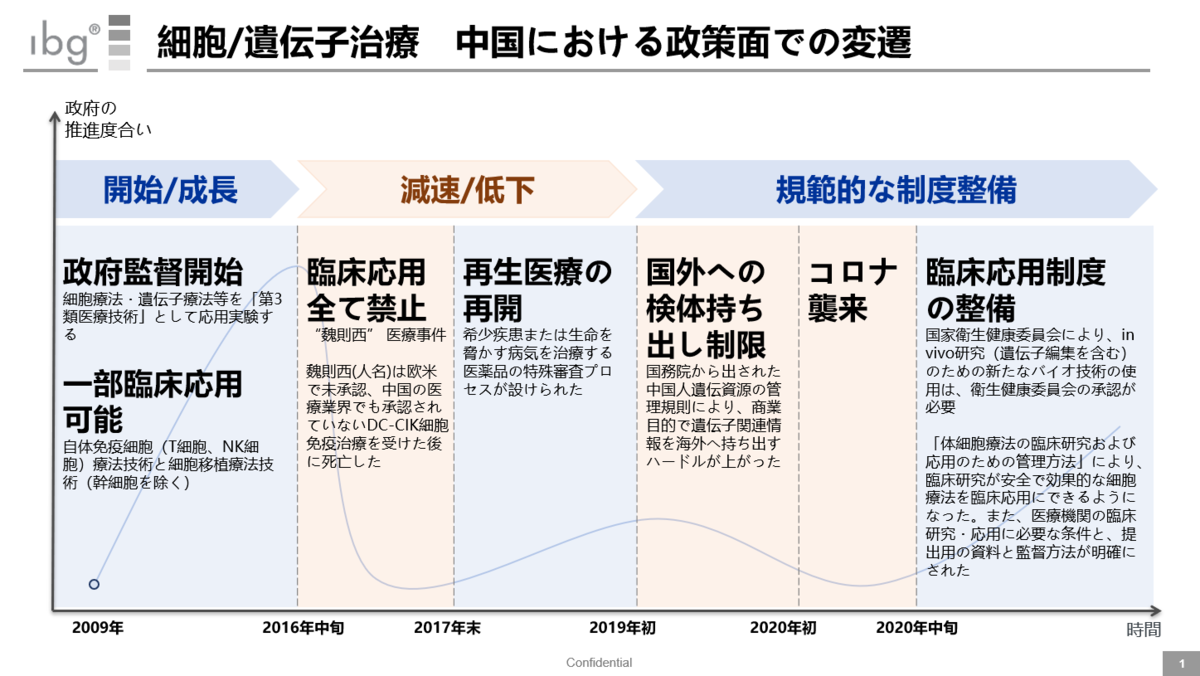
上記は、2009年からこれまでの変遷をまとめたものだ。流れとしては、以下に分類できる。
2009~2015年(立上げ期)
・中国政府として、細胞・遺伝子治療の成長を促そうと立ち上がった頃だ。一部の臨床技術は承認されていた。
2016年~2019年(減速期)
・メディアでも大きく取り上げられたのでご存じの方もいると思うが、この頃“魏則西”医療事件が発生した。これにより、細胞・遺伝子治療に対する政府/政策の推進度が大きく下がった。
・また中国人の遺伝子サンプルや関連情報の国外持ち出しを強く制限する規制が出されたのもこの頃だ。
2020年~(規範化整備期)
・規範化されたルールの下で細胞/遺伝子治療を成長させようと、様々な原則・規制が発表されている。(詳細は以下を参照)
ここ数年出されている規範化ルール
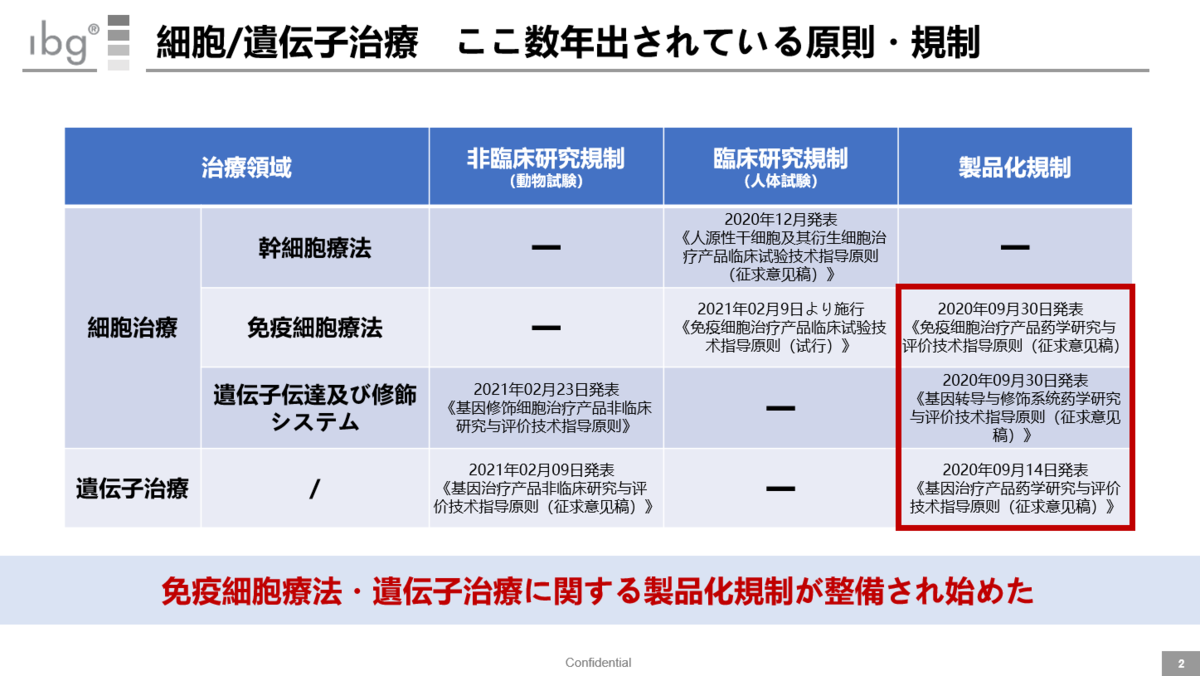
2020年以降出されている原則・規制を、上記のフレームワークを使って整理した。
例えば、真ん中にある2021年2月9日より施行された《免疫細胞治療製品臨床試験技術指導原則(試行)》は以下のような内容だ。
・中国国内での登録・上市を目的とする医薬品に対して、臨床試験の設計内容・データ分析等に対する技術指導内容を提示
・《薬品管理法》、《薬品登録管理弁法》といった薬品管理関連法規に基づいて登録申請する免疫細胞治療薬が対象
さいごに
しばらく情報発信が滞っていました。できるだけ高い頻度で発信するようにしていきます。
不明点などある方は、ご連絡いただけると幸いです。
以上
この記事は各種公開情報等を基に、ibgが内容を作成したものです。
