はじめに
2020年12月28日、国家医療保障局・人力資源社会保障部より《国家基本医療保険・工傷保険・生育保険医薬品リスト(2020年)の通知》が発表された。
この際、メディアで注目されたのはPD-1に関する国家談判の結果だ。
談判プロセスまで残ったPD-1は7品目あったが、結果的にNRDLへ収載されたのは中国系製薬メーカーの以下3品目だった。
・Tislelizumab(百済神州、適応症2つ)
・Toripalimab(君実、適応症1つ)
・Camrelizumab(恒瑞、適応症4つ)
グローバルのPD-1/PD-L1市場だが、2030年には739億ドルに達すると見込まれている。そのうち中国市場は、131億ドルを占めると言われている。
今回のNRDLに上記3品目が収載されたことで、中国におけるPD-1市場がより活発になるだろう。
上記で取り上げたTislelizumab(チスレリズマブ、百済神州)について。
ノバルティスファーマが百済神州に対して、アメリカ/カナダ/EU加盟国/イギリス/日本/メキシコ/ノルウェー/スイス/アイスランド等における、Tislelizumabの開発・生産・商業化の権利を取得したと、2021年1月12日に発表された。
今回は、こちらの内容を紹介したい。
ノバルティスと百済神州の提携内容
百済神州が開発したPD-1薬Tislelizumab(チスレリズマブ)について、両社の提携内容は以下の通りだ。
・ノバルティスは、アメリカ/カナダ/EU加盟国/イギリス/日本/メキシコ/ノルウェー/スイス/アイスランド等におけるTislelizumabの開発・生産・商業化の権利を取得
・中国におけるTislelizumabの全ての権利は、引続き百済神州が持つ
・上記地域において、双方でTislelizumabの開発を行い、契約期限後の登録申請や承認取得後の営業活動はノバルティスが責任を持つ
・地域を問わず、双方はTislelizumabの様々な抗癌剤との併用に向けた臨床研究を行っていく
・百済神州は北アメリカ地域での製品の販売を共同で行うことができる。その際、一部のオペレーション費用はノバルティスが負担する
・百済神州に支払われる手付金は6.5億ドル、承認取得後に13億ドル、販売開始後に2.5億ドルが支払われる
提携に関する総額は22億ドルを超え、中国医薬品の業務提携額として最高額となった。
百済神州について
百済神州とは、2010年に北京で設立されたバイオ医薬品開発メーカーだ。
戦略的に腫瘍領域における革新的な分子標的薬と免疫療法薬の研究開発・生産・販売を行っており、2016年に米ナスダック、2018年に香港証券取引所へ上場した。
また2019年には、アムジェンが百済神州の株式20.5%(27億ドル)を取得する形で戦略提携を締結した。
現在30種以上の臨床試験が行われており、2022年末までには12種が上市される計画だ。
さいごに
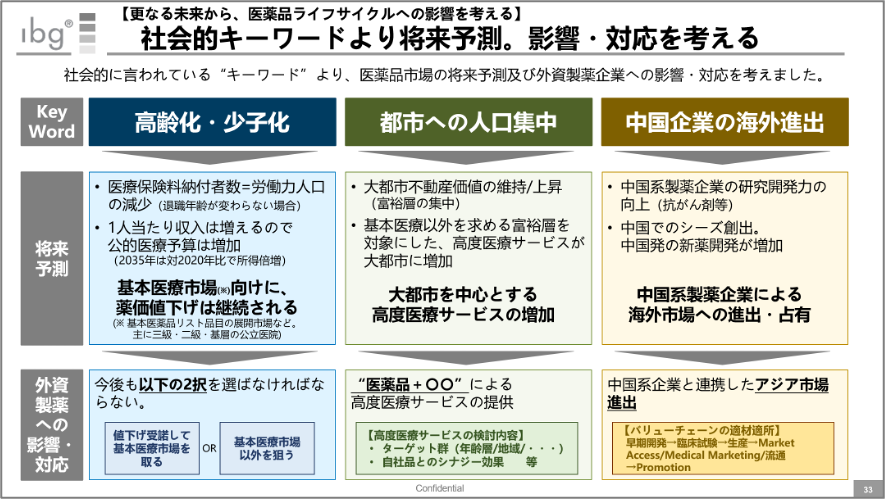
上記スライドは、以前講演した資料から抜粋したものだ。
今回紹介した内容は、スライド内の一番右(中国企業の海外進出)に関連するものだが、ノバルティスの例からも言えるように、MNC大手が中国系製薬メーカー開発品の海外業務提携(中国市場以外での提携)を図っている状況だ。
一般的には「中国医薬品メーカー=ジェネリック薬メーカー」と定義されやすいが、抗体医薬品・再生治療薬・遺伝子治療薬への対応も進んできている。
変化のスピードは激しい。
既定概念にとらわれず、事実取得と将来検討を引続き行っていきたい。
以上
この記事は各種公開情報・ibg経験等を基に、ibgが内容を作成したものです。
